院况简介
1949年,伴随着新中国的诞生,中国科学院成立。
作为国家在科学技术方面的最高学术机构和全国自然科学与高新技术的综合研究与发展中心,建院以来,中国科学院时刻牢记使命,与科学共进,与祖国同行,以国家富强、人民幸福为己任,人才辈出,硕果累累,为我国科技进步、经济社会发展和国家安全做出了不可替代的重要贡献。 更多简介 +
院领导集体
创新单元
科技奖励
科技期刊
工作动态/ 更多
中国科学院学部
中国科学院院部

语音播报

金属蛋白约占整个蛋白质组三分之一及以上,参与调控几乎所有生命过程。其中,金属离子在蛋白质结构稳定、催化反应、功能调控以及信号传导等方面发挥关键作用。然而,现有金属蛋白组学研究存在分析深度不足、金属结合位点难以精准定位、研究的金属离子种类较为单一等局限。因此,系统性绘制哺乳动物细胞中,多种金属离子的全景“金属蛋白质组”图谱,尚未被充分解决。
近日,中国科学院上海有机化学研究所研究员张耀阳团队,首次开发了新的半胱氨酸特异性金属蛋白组分析策略——Cysteine-centered Metalloproteome Profiling(CysMP)。该方法为解码人体金属蛋白质组提供了高灵敏、高通量、高特异性技术支持,并为系统研究金属蛋白质组提供了创新性解决方案。
CysMP方法结合半胱氨酸化学探针与特异金属蛋白组重建技术,在哺乳动物细胞中系统解析了11种与人类生理病理密切相关的关键金属离子,包括锌(Zn2+)、铜(Cu2+)、钙(Ca2+)、钴(Co2+)、镍(Ni2+)、锰(Mn2+)、铁(Fe3+和Fe2+)、锑(Sb3+)、铬(Cr3+)以及锡(Sn2+),与蛋白质之间的互作,鉴定到8895个半胱氨酸位点金属结合位点,覆盖4150种蛋白质,形成目前已知最全面的半胱氨酸金属结合数据集。研究发现,不同金属离子在蛋白结合上,表现出特异性和偏好性。其中,铜和锌蛋白互作范围最广,涉及多个关键生命过程,揭示了大量潜在的金属蛋白,为进一步研究金属离子生物学功能奠定基础。
在功能验证中,研究团队发现,铜和锌能够结合并抑制关键代谢酶5'-甲硫腺苷磷酸化酶(MTAP),使MTA(5'-甲硫腺苷)积累并影响下游代谢。进一步,研究首次发现铜离子可抑制糖酵解关键酶磷酸甘油酸激酶1(PGK1)活性,从而下调多种糖酵解相关代谢水平,显著降低细胞活力。这一发现为铜死亡机制提供了分子层面的新证据,揭示铜离子通过调控关键代谢酶活性参与细胞命运调控。
该研究开发的CysMP策略为研究金属离子失调与蛋白质组功能及疾病之间的关系提供了系统性资源。同时,CysMP提供了金属特异性的全景蛋白质组学视角,系统解析了哺乳动物细胞中金属结合半胱氨酸位点,揭示了金属离子在生物学调控作用。该方法实现了金属种类和结合位点的双特异性分辨率,克服了传统金属蛋白研究策略的局限性,为金属蛋白质组学研究设立了新标准。
相关研究成果发表在《科学进展》(Science Advances)上。研究工作得到国家自然科学基金委员会、中国科学院、上海市的支持。
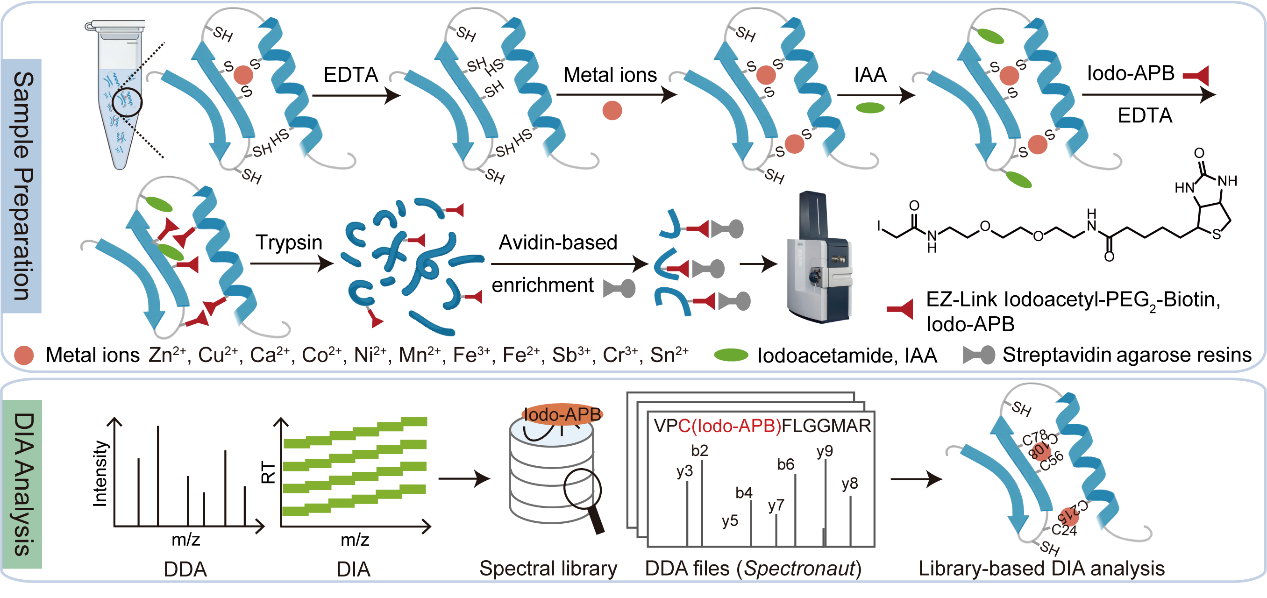
CysMP策略流程图
扫一扫在手机打开当前页

© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)
© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)
© 1996 - 中国科学院 版权所有
京ICP备05002857号-1 京公网安备110402500047号
京公网安备110402500047号
网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话:86 10 68597114(总机)
86 10 68597289(总值班室)











