院况简介
1949年,伴随着新中国的诞生,中国科学院成立。
作为国家在科学技术方面的最高学术机构和全国自然科学与高新技术的综合研究与发展中心,建院以来,中国科学院时刻牢记使命,与科学共进,与祖国同行,以国家富强、人民幸福为己任,人才辈出,硕果累累,为我国科技进步、经济社会发展和国家安全做出了不可替代的重要贡献。 更多简介 +
院领导集体
创新单元
科技奖励
科技期刊
工作动态/ 更多
中国科学院学部
中国科学院院部

语音播报

神经轴突损伤后,远离胞体的一侧发生渐进性串珠化、碎片化改变,进而崩解并被清除,这一病理过程被称为沃勒变性。NMNAT2是维持轴突完整性的关键蛋白,在神经损伤后快速耗竭而致沃勒变性发生,但在神经元中调控其蛋白降解的具体机制尚不完全清楚。
近日,中国科学院上海有机化学研究所方燕姗团队,鉴定出FBXO21是介导神经元中NMNAT2泛素化和降解的特异性F-box蛋白和关键因子。研究发现,在小鼠背根神经节神经元中,敲低Fbxo21引起NMNAT2蛋白水平升高,并延缓损伤引起的轴突退化。
时间动态分析证明,NMNAT2蛋白在神经元胞体和轴突中、损伤前后的降解速率基本相当,提示NMNAT2降解具有相同的调控机制,而受损轴突中NMNAT2的快速耗竭主要归因于缺少胞体来源的新生NMNAT2蛋白。无论是在胞体还是轴突、无论是完好还是受损的轴突,FBXO21对NMNAT2蛋白稳定性以及轴突完整性均发挥着重要的调控作用。
变性免疫沉淀和体外泛素化实验显示,FBXO21可与SKP1、CUL1和RBX1形成SCFFBXO21E3泛素连接酶复合物,介导NMNAT2的泛素化。SCFFBXO21泛素化NMNAT2中ISTID结构域的赖氨酸155(K155),该位点的泛素化缺陷突变K155R延长NMNAT2半衰期,具有更强的轴突保护作用。将NMNAT1或NMNAT3亚型中的ISTID域替换为NMNAT2的ISTID,导致原本稳定的前两者蛋白快速降解,而在其中引入K155R突变则可消除此效应。这说明,在进化上,NMNAT2的超短半衰期依赖于ISTID中的K155泛素化,揭示了NMNAT2独特的蛋白不稳定性的分子结构基础。
科研团队构建出Fbxo21敲除小鼠,并发现NMNAT2蛋白水平在该小鼠的神经组织中特异性升高。进而,团队利用小鼠坐骨神经损伤模型,证实了Fbxo21敲除可在体内延缓受损神经轴突的退化。
上述研究揭示了FBXO21是调控NMNAT2稳定性的关键因子,为轴突退化机制提供了新见解。同时,研究鉴定出SCF复合物中决定NMNAT2底物特异性的F-box蛋白FBXO21,为靶向NMNAT2治疗神经损伤和神经退化疾病提供了可能的靶点和干预策略。
相关研究成果在线发表在《细胞生物学杂志》(Journal of Cell Biology)上。研究工作得到国家自然科学基金、国家重点研发计划、中国科学院相关项目等的支持。
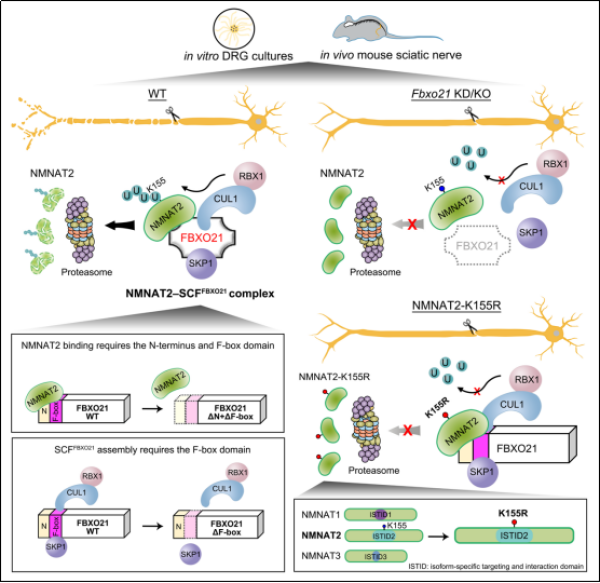
FBXO21介导NMNAT2泛素化和蛋白降解从而调控轴突退化的机制示意图
扫一扫在手机打开当前页

© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)
© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)
© 1996 - 中国科学院 版权所有
京ICP备05002857号-1 京公网安备110402500047号
京公网安备110402500047号
网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话:86 10 68597114(总机)
86 10 68597289(总值班室)











