院况简介
1949年,伴随着新中国的诞生,中国科学院成立。
作为国家在科学技术方面的最高学术机构和全国自然科学与高新技术的综合研究与发展中心,建院以来,中国科学院时刻牢记使命,与科学共进,与祖国同行,以国家富强、人民幸福为己任,人才辈出,硕果累累,为我国科技进步、经济社会发展和国家安全做出了不可替代的重要贡献。 更多简介 +
院领导集体
创新单元
科技奖励
科技期刊
工作动态/ 更多
中国科学院学部
中国科学院院部

语音播报

病原菌表面粘附素通过特异性分子,识别介导病原体与宿主的紧密接触,并在感染过程中呈现动态调控特征。然而,关于细菌-宿主界面粘附强度的动态调控机制尚不明确。
具核梭杆菌是在结直肠癌患者肠道中显著富集的厌氧菌,可通过黏附素CbpF特异性结合癌细胞表面的高表达的CEACAM1和CEACAM5,其中CEACAM1激活后,还会导致免疫细胞活性受抑制。因此,阐明CbpF与CEACAM1和CEACAM5相互作用的机制,对开发针对细菌促进肿瘤发生的靶向疗法具有重要意义。
中国科学院微生物研究所与上海交通大学医学院附属仁济医院合作,从原子层面解析了具核梭杆菌CbpF与受体CEACAM1和CEACAM5结合的关键机制。
研究团队运用冷冻电镜技术,解析了CbpF分别与受体CEACAM1和CEACAM5结合的高分辨率结构。在复合物结构中,CbpF以三聚体形式组装,形成对称的3:3结合模式。同时,研究还观察到两个CbpF三聚体与一个处于二聚体状态的受体分子相结合的复合物颗粒。
基于这一发现,科研团队提出了“粘扣”模型,即高度灵活的CbpF蛋白充当“毛面”,通过多结合位点与宿主受体“钩面”相互作用,从而建立起紧密黏附。该机制可能使细菌能够在机械应力作用下灵活调节黏附强度,在需要时牢牢黏附,在必要时轻松脱离来适应复杂的生理环境。
上述研究深化了对具核梭杆菌在肿瘤组织中定植以及免疫抑制机制的理解,为开发新型抗肿瘤和抗菌药物提供了关键靶点。
相关研究成果发表在《美国国家科学院院刊》(PNAS)上。
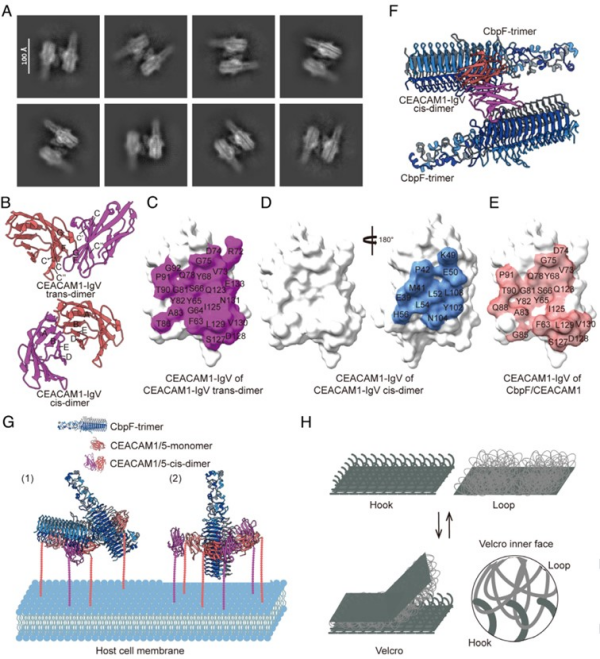
CbpF与受体CEACAM1和CEACAM5结合的“粘扣”模型

© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)
© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)
© 1996 - 中国科学院 版权所有
京ICP备05002857号-1 京公网安备110402500047号
京公网安备110402500047号
网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话:86 10 68597114(总机)
86 10 68597289(总值班室)











