院况简介
1949年,伴随着新中国的诞生,中国科学院成立。
作为国家在科学技术方面的最高学术机构和全国自然科学与高新技术的综合研究与发展中心,建院以来,中国科学院时刻牢记使命,与科学共进,与祖国同行,以国家富强、人民幸福为己任,人才辈出,硕果累累,为我国科技进步、经济社会发展和国家安全做出了不可替代的重要贡献。 更多简介 +
院领导集体
创新单元
科技奖励
科技期刊
工作动态/ 更多
中国科学院学部
中国科学院院部

语音播报

病毒离子通道是广泛存在于病毒的膜蛋白,具有增强膜通透性、调节膜内外离子稳态、改变细胞器pH值等功能。病毒离子通道能调节自身或宿主细胞的生理环境,为病毒自身繁殖提供有利条件。同时,病毒离子通道作为毒力因子,可影响宿主细胞的生理功能,是病毒致病进程的重要因素。已有研究表明,冠状病毒的包膜蛋白(E)能够形成离子通道,参与病毒生命进程与宿主细胞致病进程,是一类潜在的抗冠状病毒药物靶点。
严重急性呼吸综合征冠状病毒(SARS-CoV-1)、中东呼吸综合征冠状病毒(MERS-CoV)及新型冠状病毒(SARS-CoV-2)是三种高致病性的冠状病毒。其中,SARS-CoV-1和SARS-CoV-2的E蛋白已被证实为阳离子通道,能够通透钾、钠、钙、镁等多种阳离子。这两种E蛋白在中性pH下易形成紧密的五螺旋束,并构成不透水的孔道,而在酸性和钙离子条件下,E蛋白跨膜域中间的三个苯丙氨酸残基会旋转到脂质一侧,进而打开离子通道。但是,MERS-E蛋白的结构特征与通道属性尚不明晰。
近期,中国科学院上海药物研究所研究员高召兵团队联合美国麻省理工学院教授Mei Hong团队,揭示了MERS-E蛋白作为离子通道的结构基础和功能属性,为靶向病毒离子通道的抗冠状病毒药物研发提供了理论指导。
研究人员结合核磁共振、单通道电生理及单点突变等技术,解析了MERS-E蛋白的通道结构,并揭示了其相关功能属性。研究纯化了全长的MERS-E蛋白,通过单通道电生理检测技术证实其阳离子通透性,且通道属性分析揭示,MERS-E通道电导与SARS1/2-E存在显著区别。同时,核磁共振结构解析显示,MERS-E的五聚体结构展示了由疏水与极性残基共同稳定、具有两个孔道收缩部位的阳离子通道,其构象和功能调控机制与SARS1/2-E存在明显差异。MERS-E跨膜区高分辨结构表明,其N端的极性-芳香网络(N15A、F13V)与C端的芳香网络(F33V)或对通道调控起关键作用。进一步,研究针对这两部分调控网络的单点突变会显著降低MERS-E的通道活性,验证了这些位点的重要作用。
这一研究揭示了MERS-E跨膜区芳香网络协同介导阳离子通透的作用机制,解析了MERS-E蛋白的通道属性与结构基础,并将为靶向MERS-E通道的抗病毒药物研发提供理论指导。
相关研究成果以Ion channel structure and function of the MERS coronavirus E protein为题,发表在《科学进展》(Science Advances)上。研究工作得到中国国家自然科学基金委员会、美国国立卫生研究院、美国国家科学基金会的支持。
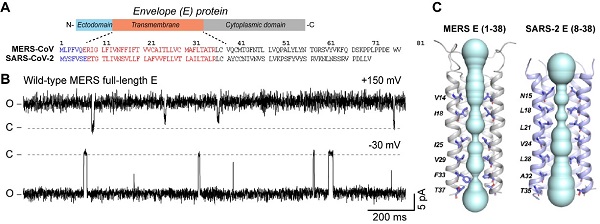
MERS-E 蛋白形成病毒离子通道
扫一扫在手机打开当前页

© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)
© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)
© 1996 - 中国科学院 版权所有
京ICP备05002857号-1 京公网安备110402500047号
京公网安备110402500047号
网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话:86 10 68597114(总机)
86 10 68597289(总值班室)











