院况简介
1949年,伴随着新中国的诞生,中国科学院成立。
作为国家在科学技术方面的最高学术机构和全国自然科学与高新技术的综合研究与发展中心,建院以来,中国科学院时刻牢记使命,与科学共进,与祖国同行,以国家富强、人民幸福为己任,人才辈出,硕果累累,为我国科技进步、经济社会发展和国家安全做出了不可替代的重要贡献。 更多简介 +
院领导集体
创新单元
科技奖励
科技期刊
工作动态/ 更多
中国科学院学部
中国科学院院部

语音播报

10月21日,《美国国家科学院院刊》(PNAS)在线发表了中国科学院上海营养与健康研究所姚依昆研究组等合作完成的题为AMBRA1 controls the translation of immune-specific genes in T lymphocytes的研究论文。该研究筛选并鉴定出FAS介导的T细胞死亡过程中的关键调控蛋白AMBRA1,揭示了AMBRA1在翻译水平控制TCR信号传导、T细胞周期和T细胞死亡的新机制。
抗原刺激T细胞受体后,T细胞迅速活化并分化为效应T细胞或记忆T细胞。活化的T细胞快速启动糖酵解以产生能量和促进T细胞增殖的必需成分,而在这一过程中T细胞需要快速合成大量蛋白。因此,除转录水平调控外,高效的翻译水平调控在T细胞激活中同样可能发挥重要作用。此前,T细胞激活和激活诱导的T细胞死亡的研究聚焦于T细胞转录层面的调控,而关于T细胞翻译水平的研究不足。
为揭示介导T细胞死亡的新调控因子,该研究利用全基因组CRISPR文库筛选,发现支架蛋白AMBRA1在FAS介导的T细胞死亡过程中发挥重要作用。AMBRA1蛋白是系统发育保守的支架蛋白。既往研究显示,AMBRA1是自噬、E3泛素连接酶活性和细胞周期蛋白的关键调控因子,但未见AMBRA1在淋巴细胞中的功能及翻译相关调控机制的报道。
该研究利用流式细胞术、免疫印迹以及一系列功能实验验证发现,敲除AMBRA1能够降低FAS蛋白表达,抑制FAS途径诱导的T细胞凋亡。进一步,在机制探究中,研究人员利用OPP掺入结合点击化学、蔗糖梯度离心分离核糖体及其结合的mRNA等手段发现,AMBRA1促进FAS mRNA翻译,且这一调节作用对于T细胞活化后FAS的完全表达至关重要。
该研究通过RNA-seq和质谱结果发现了TCR信号能够刺激AMBRA1表达增加;进而利用TCR下游通路抑制剂和AMBRA1 5‘UTR报告基因发现了TCR刺激诱导的翻译控制通路。这一翻译控制通路可在T细胞活化后通过CD28-PI3K-mTORC1-eIF4F轴增强AMBRA1翻译,调节FAS和其他免疫相关基因的表达。
进一步,科研人员利用一系列蛋白互作和翻译水平检测技术如Bio-ID、SunSET、SILAC并结合mePROD等发现,AMBRA1与多个核糖体蛋白互作,促进多种核糖体生物合成相关蛋白的翻译。全蛋白组学分析等实验显示,除了FAS,较多TCR信号基因如CD69、CD28、PD1和CTLA4的蛋白翻译同样受到AMBRA1调控,表明AMBRA1对T细胞信号蛋白的翻译具有广泛影响。
该研究发现了AMBRA1基因在TCR活化和FAS诱导的T细胞死亡信号的翻译调控中的作用,为探讨TCR信号的翻译调控并开发针对翻译调控环节的免疫疗法提供了可能的方向。
研究工作得到国家重点研发计划、国家卫健委科技重大专项、国家自然科学基金、中国科学院与美国联邦科研机构合作项目等的支持。该工作由营养与健康所和美国国立卫生研究院的科研人员合作完成。
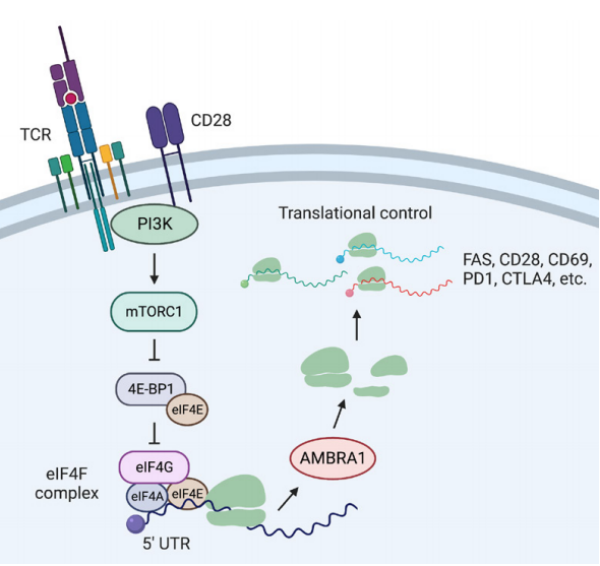
TCR信号通过AMBRA1促进下游FAS等蛋白翻译,介导T细胞周期和T细胞死亡的机制

© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)
© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)
© 1996 - 中国科学院 版权所有
京ICP备05002857号-1 京公网安备110402500047号
京公网安备110402500047号
网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话:86 10 68597114(总机)
86 10 68597289(总值班室)











