院况简介
1949年,伴随着新中国的诞生,中国科学院成立。
作为国家在科学技术方面的最高学术机构和全国自然科学与高新技术的综合研究与发展中心,建院以来,中国科学院时刻牢记使命,与科学共进,与祖国同行,以国家富强、人民幸福为己任,人才辈出,硕果累累,为我国科技进步、经济社会发展和国家安全做出了不可替代的重要贡献。 更多简介 +
院领导集体
创新单元
科技奖励
科技期刊
工作动态/ 更多
中国科学院学部
中国科学院院部

语音播报

细胞代谢为生命过程提供能量。同时,代谢物可共价修饰蛋白质来发挥信号传导功能。虽然许多代谢物在代谢通路中的作用广为人知,但它们介导细胞信号调控的功能有待探索。酮体(包括丙酮、乙酰乙酸和β-羟基丁酸)为脂质代谢产物。在葡萄糖缺乏的状态下,肝脏产生的酮体可用作多种组织的替代能源,且与多种病理生理状态密切相关。美国芝加哥大学教授赵英明团队和中国科学院上海药物研究所研究员黄河课题组前期合作揭示了β-羟基丁酸驱动的赖氨酸β-羟基丁酰化修饰(Kbhb)可能介导多个重要细胞进程,并鉴定了Kbhb的调控酶及底物谱。然而,作为类似的酮体代谢产物乙酰乙酸,其非代谢功能及相关的分子机制尚未明确。
基于上述科学问题,黄河课题组、赵英明团队,联合韩国成均馆大学教授Sangkyu Lee团队,鉴定了一种由乙酰乙酸驱动形成的全新组蛋白修饰——赖氨酸乙酰乙酰化(Kacac),并揭示了该新型修饰的关键调控因子HBO1。6月29日,相关研究成果以Identification of Histone Lysine Acetoacetylation as aDynamic Post-Translational Modification Regulated byHBO1为题,在线发表在Advanced Science上。
该团队假设并验证了短链脂肪酸乙酰乙酸可作为赖氨酸乙酰乙酰化修饰(Kacac)的前体。运用生物大分子高分辨质谱、稳定同位素标记及免疫学等手段,科研人员鉴定并验证了组蛋白Kacac修饰在人、小鼠、斑马鱼的细胞中广泛存在。
进一步的细胞和体外水平实验证实了HBO1可以催化Kacac,表明HBO1是Kacac的“Writer”。研究人员通过对HDAC1-11进行筛选,发现了HDAC3具有去除Kacac的催化活性,表明HDAC3是赖氨酸Kacac的“Eraser”。
进而,研究发现通过乙酰乙酸乙酯(EAA)和酮体生成抑制剂处理细胞可以动态调节Kacac修饰水平。通过深入的Kacac组学分析,该研究在哺乳动物组蛋白上鉴定到33个独特的Kacac位点,描绘了组蛋白Kacac在物种和器官之间的底物谱。对Kacac修饰底物的进一步分析揭示了酮体的非代谢功能。
该研究首次揭示了全新的蛋白修饰类型Kacac,探索了调控Kacac的关键酶,拓展了Kacac调控的蛋白质底物谱,阐释了Kacac参与细胞代谢调控进程的新机制和新途径,为进一步剖析Kacac修饰在各种生理、病理条件下的作用提供了理论依据。
研究工作得到韩国国家研究基金会、美国国立卫生研究院、国家自然科学基金委员会和上海市的支持。韩国庆北大学的科研人员参与研究。
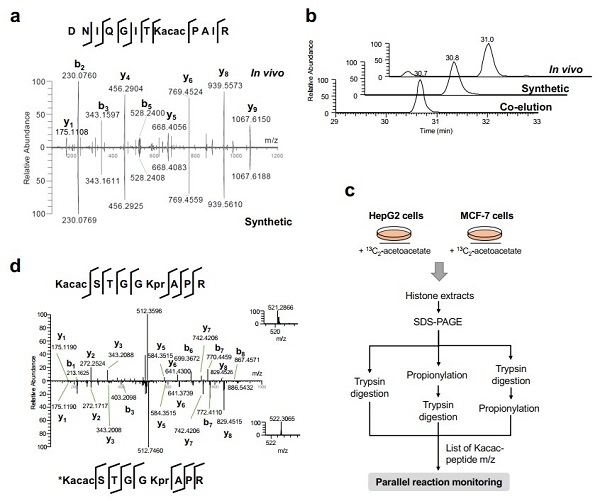
赖氨酸乙酰乙酰化的鉴定
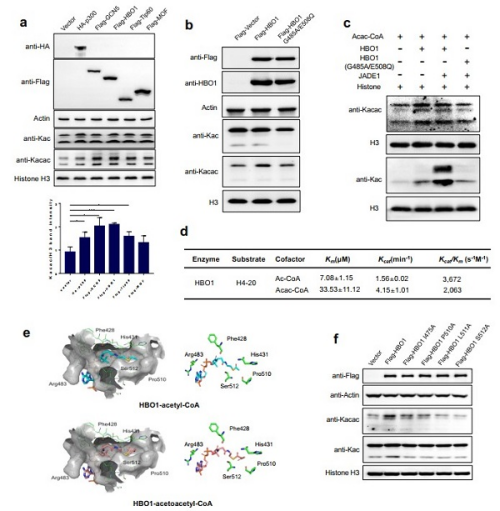
HBO1催化乙酰乙酰转移酶活性

© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)
© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)
© 1996 - 中国科学院 版权所有
京ICP备05002857号-1 京公网安备110402500047号
京公网安备110402500047号
网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话:86 10 68597114(总机)
86 10 68597289(总值班室)











